3月12日,国务院联防联控机制召开新闻发布会。国家卫生健康委新闻发言人米锋表示,总体上,我国本轮疫情流行高峰已经过去。
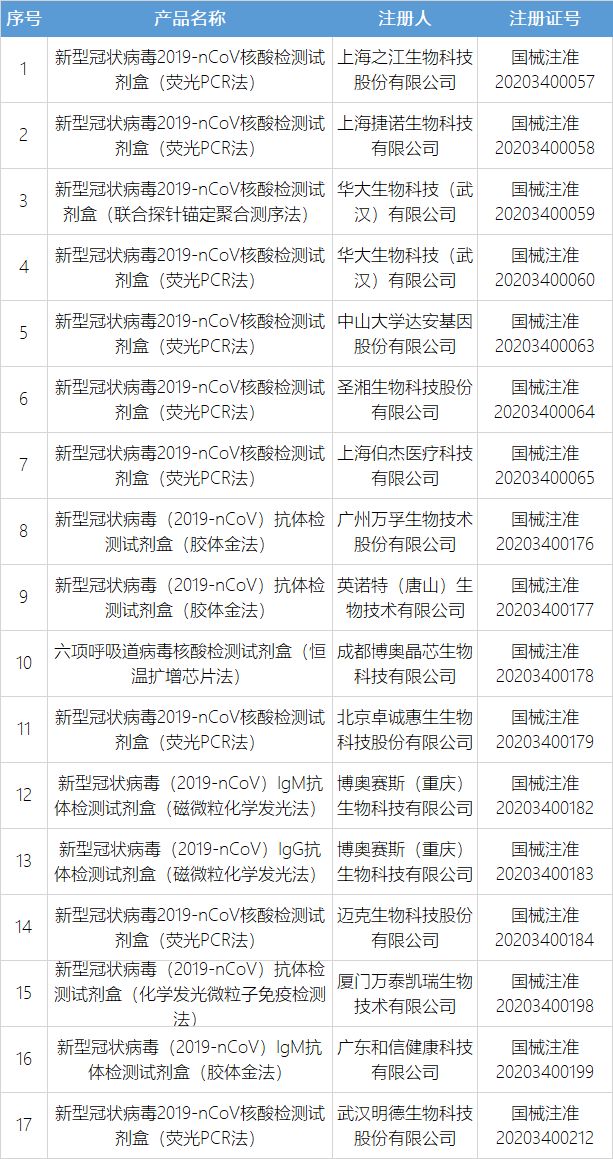
3月12日,国家药品监督管理局应急审批通过武汉明德生物科技股份有限公司新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)。该产品采用多重PCR-荧光探针检测方法,结合一步法RT-PCR技术,对新型冠状病毒2019-nCoV感染的肺炎疑似病例、疑似聚集性病例患者、其他需要进行新型冠状病毒感染诊断或鉴别诊断者的口咽拭子、鼻咽拭子和痰液样本中新型冠状病毒(2019-nCoV)ORF1ab基因、N基因进行检测。该产品获批上市,扩大了新冠病毒核酸检测试剂的供应,进一步服务疫情防控的需要。截至目前,国家药品监督管理局共批准新冠病毒核酸检测试剂11个,抗体检测试剂6个。
国家药监局药品监管司司长袁林在答记者问时表示:新冠肺炎疫情发生以来,为了及时满足疫情防控工作的需要,从国家药品监督管理局到各省药品监督管理局都积极的行动起来,迅速地开辟了医疗器械应急审批的绿色通道,全力服务于疫情防控大局。同时,我们也在积极地、及时地安排部署各省药品监督管理部门,积极地鼓励医疗器械生产企业紧急安排相关产品的生产,并积极扩大相应的产能。特别是我们各地药品监管部门也都统一按照国家局的安排、部署和要求,加快了医用防护产品注册审批、生产许可等各项工作。对疫情防控所需的医疗器械注册申请,按照医疗器械应急审批程序的要求,在确保安全和有效的基础上加快审评审批工作。特别是对医用口罩、医用防护服等医疗器械产品的注册、生产许可和检验检测等我们实施了特别措施,在不降低整体标准的前提下合并整合相关的审评审批流程,全力满足疫情防控需要。

国家药监局药品监管司司长袁林
在这里给大家提供两组数据,第一个数据,截至3月11日,全国共有医用防护服医疗器械注册证216张,因疫情防控应急审批共新增加175张,现在共有相关生产企业184家,因为这次新冠肺炎疫情防控我们应急审批的企业新增了143家,据统计最大的日产能力已经达到842000多套。第二个数据,截至3月11日,全国共有医用防护口罩注册证119张,因疫情防控我们应急审批了66张,现在共有生产企业96家,也是因为疫情防控的急需,国家药品监督管理局应急审批的企业新增了43家,据统计最大日产能已经超过180万个。
对于提出申请生产防疫相关医疗器械的企业,如果符合应急审批程序的要求,特别是临床急需的相关医疗器械,而且没有同类产品在国内上市,或者已经有同类产品在国内上市但不能满足防控需求的,经过专家组的审核和专业技术评估等程序确认后可以纳入应急审批。如果有企业在相关的医疗器械审评审批过程中遇到相关的问题甚至困难,可以根据申报的医疗器械产品的不同类别,及时与国家药监局或省级药品监管部门联系。
如今,国内疫情总体保持在较低水平。随着疫情缓解,部分省份宣布停止部分医疗器械应急审批。
3月9日,陕西省药监局发布公告称:自2020年2月28日起,陕西省新冠肺炎疫情防控应急响应级别由一级应急响应调整为三级应急响应,结合当前疫情防控实际情况,决定对《关于对防控疫情用医疗器械实行应急审批的公告》有关事项予以调整。
一、自3月10日起,停止医用一次性防护服的应急审批,医用一次性防护服的注册和生产许可按正常程序办理。
二、医用一次性防护服生产企业3月10日前完成样品生产,注册检验结果符合要求的,可继续按应急审批程序办理。
3月3日,浙江省药监局发布公告称:自2020年3月2日起,浙江省疫情防控应急响应等级从原来的一级调整为二级。结合我省当前新冠肺炎疫情防控形势和防控疫情用医疗器械生产供应情况,决定对实施《防控新型冠状病毒感染的肺炎疫情所需医疗器械应急审批程序》有关事项予以调整。
一、医用一次性防护服、医用防护口罩自公告之日起不再纳入应急审批。已纳入应急审批的医用一次性防护服、医用防护口罩,企业应于3月20日前完成送样检验,经检验符合要求可继续予以应急审批注册。检验不合格的,终止该产品应急审批。
二、一次性使用医用口罩、医用外科口罩、额温计可继续按《程序》要求申报应急审批,其它产品不再纳入应急审批。各市市场监督管理局应对申报企业是否具备相应产品的生产条件和质量管理能力进行严格审核,并督促指导企业逐步提高产品执行标准,满足医疗器械生产质量管理规范要求。
三、已通过应急审批获得医疗器械注册证的产品,企业需继续生产销售的,应在注册证到期前申报延续注册,延续注册时需取得产品全性能检验合格报告,并按照原国家食品药品监督管理总局《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》要求补齐应急审批时容缺的注册资料,经审评和现场检查符合医疗器械生产质量管理规范要求方可准予延续注册。
四、《程序》有效期至我省新冠肺炎疫情防控二级响应结束之日。



